DMD - Leki w badaniach - przegląd
Główne strategie terapeutyczne
W niniejszym opracowaniu omówine zostaną w ogólny sposób terapie nad którymi pracują naukowcy i firmy farmaceutyczne. Bardziej szczegółowe informacje dotyczące toczących się badań klinicznych znajdziecie Państwo w innych dokumentach na naszej stronie.
W chwili obecnej są dwie główne strategie terapeutycznych dotyczące badań nad Dystrofią Mięśniową Duchenne’a (DMD).
I. Strategia ukierunkowana na przywrócenie funkcji dystrofiny
II. Strategia niwelowania zmian patologicznych.
I. Strategia przywrócenia dystrofiny
Pomimo prowadzonych wileu badań przedklinicznych i klinicznych, terapie ukierunkowane na przywrócenie dystrofiny wciąż stoją przed ogromnymi problemami.
Pierwszym problemem jest to, że terapie te mogą spowolnić postęp DMD, ale nie przywrócą prawidłowych funkcji tkanek mięśniowych ze względu na degeneracyjną naturę DMD (ciągły postęp choroby).
Drugim problemem jest to, że są trudne do zastosowania we wszystkich tkankach (komórkach) mięśniowych, które są obecne w całym organizmie w postaci mięśni poprzecznie prążkowanych (szkieletowych), mięśni gładkich i mięsnia sercowego
Terapie ukierunkowane na dystrofinę obejmują:
A. Terapie genowe,
B. Terapie komórkowe,
C. Terapie zastępowania białek.
A. Terapie genowe
Strategie terapeutyczne oparte na genach mogą potencjalnie zapewnić długotrwałe i jednorazowe leczenie DMD. W DMD delecje (usunięte eksony) koncentrują się w regionie od eksonu 43 do 55 ( Aszer et al., 2020 ), co stanowi około 60–65% zdarzeń ( Zimowski et al., 2014 ).
Opracowano kilka strategii terapeutycznych opartych na genach, w tym:
1. Exon skipping (pomijanie eksonów),
2. Odczytywanie kodonów stop,
3. Dodawanie genów
4. Terapię edycji genów.
1. Pominięcie eksonu
Tłumaczenie zasady działania pomijania eksonu (exon skipping) zaczniemy od najprostrzego mozliwego wyjaśnienia i będziemy je rozwijać tak, aby pokazać złożoność całego procesu.
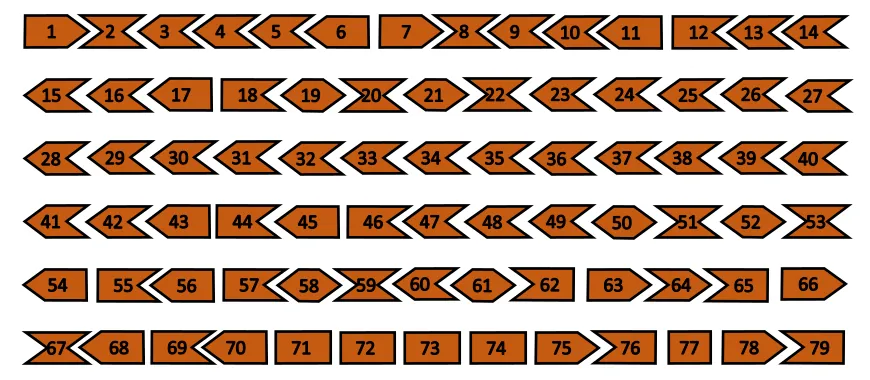
Na rysunku poniżej przedtawiony jest gen dystrofiny sładający się z 79 klocków tzw. eksonów. Rysunek jest uproszczony ale do celów poglądowych ta prostota będzie dużym ułatwieniem. Jak widać na rysunku każdy ekson ma swój początek i koniec. Eksony tworzą pewien łańcuch pasujących do siebie klocków. Te klocki pasują do siebie gdy koniec klocka wcześniejszego jest dopasowany do początku nastęnego w taki sposób, że gdy je do siebie zbliżymy stworzą nieprzerwaną strukturę.
Ta nieprzerwana struktura pozwala bez przeszkód wyprodukować w pełni funkcjonalną dystrofinę, dzięki czemu nie występuje Dystrofia Mięśniowa Duchenne’a czyli DMD.
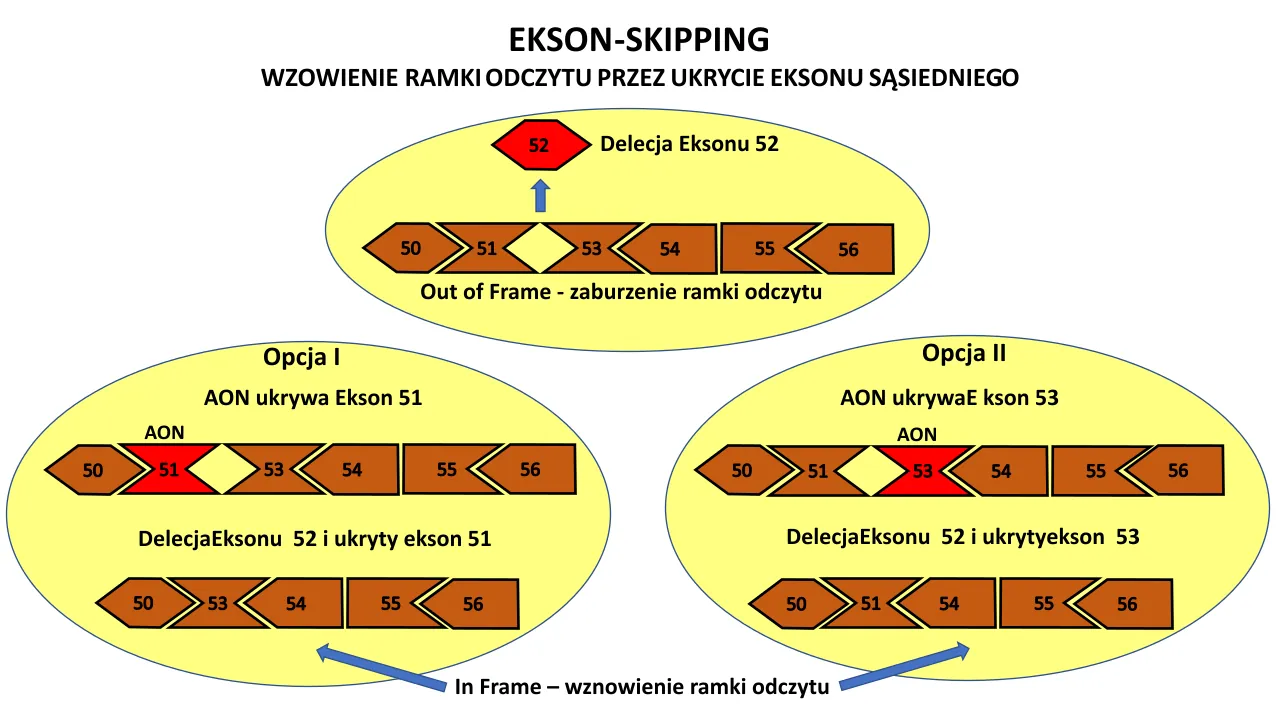
W przypadku wystąpienia mutacji polegającej np. na delecji (braku) jednego z eksonów np. eksonu 52 jak widać na rysunku poniżej, koniec eksonu 51 i początek 53 nie pasują do siebie. To niedopasowanie powoduje wstrzymanie produkcji białka dystrofiny i wywołuje DMD.
Aby chorobę złagodzić naukowcy wymyślili, że można DMD zmienić w jej łagodnieszą formę czyli Dystrofię Mięśniową Beckera. Można to zrobić przez usuniecie/ukrycie eksonu sąsiadującego bezpośrednio przy tym, którego np. brak wywołał chorobę – w naszym przypadku będzie to Ekson 51 lub Ekson 53 leżący bezpośrednio przy Eksonie 52
Aby wyjaśnić dlaczego dzieje się tak, że mutacja powoduje przerwanie ramki odczytu trzeba bardziej zagłębić się w budowę genu. Na początku tego rozdziału stwierdziliśmy, że gen zbudowany jest z eksonów. Jest to jednak tylko częściowa prawda bo w rzeczywistości są to naprzemian leżące eksony i introny. Każdy exon i intron zbudowany jest z kolei z naprzemian leżących par nukleotydów G,C,T,A – z tym, że pary tworzyą ze sobą tylko nukleotydy G-C oraz T-A. Długość pojedynczych egzonów jest zwykle krótka, od 10 do 300 nukleotydów. Ogólnie rzecz biorąc, ludzkie geny wykazują wiele krótkich eksonów (średnio 150 nukleotydów) i są oddzielone długimi intronami zawierającymi do 10.000 par nukleotydów. Średnia długości genu człowieka to 27.000 par nukleotydów, gen Dystrofiny jest najdłuższym naszym genem składającym się z 2.400.000 par nukleotydów.
Geny są nośnikiem informacji biologicznej. Wykorzystanie jej staje się możliwe w procesie ekspresji genu, w którym informacja genetyczna zawarta w genie zostaje odczytana i przetworzona na białka lub różne formy RNA.
Proces ekspresji zaczyna się od podprocesu transkrypcji (transcription) czyli kopiowania/przepisywania genu na łańcuch pre-RNA. Pre-mRNA jest łańcuchem leżących na przemian intronów i exonów, z którego następnie w podprocesie splicing’u (wycinania intronów) ulegają przetworzeniu na mRNA czyli łańcuch złożony z samych eksonów.
Ten łańcuch exonów (mRNA) jest następnie tłumaczony w procesie translacji (translation) na białka stworzone z połączonych ze sobą aminkwsów (aminoacid)
Istnieją trzy różne podejścia eksperymentalne dotyczące pomijania eksonów (exon-skipping): zastosowanie oligonukleotydów antysensownych (AON), edycja DNA (CRISPR) i blokowanie splicingu za pośrednictwem U7 snRNP.
Pominięcia eksonu za pomocą oligonukleotydów antysensownych (AON) polega na do wiązania się z pre-mRNA (przed splicingiem) w celu modulowania splicingu RNA. Te podejścia do oligonukleotydów wykorzystywały wiele chemii dla leku, ze zmiennym powodzeniem, i jest to omówione w dalszej części tego tekstu.Aby wyjaśnić pominięcie eksonu (exon-skipping), leki oligonukleotydowe wiążą się z pre-mRNA dystrofiny (przed splicingiem) i blokują włączenie eksonu sąsiadującego z delecją genu pacjenta ( Fig. 1 , 2 ). 79 egzonów genu DMD często zaczyna się i kończy tępymi końcami, gdzie aminokwasy kodowane przez eksony są w pełni kodowane przez kodon trypletowy znajdujący się w eksonie. Na przykład, jak pokazano na rys. 1(zauważ, że gen jest zorientowany od prawej do lewej, więc dolna nić jest odczytywana jako zakodowany RNA), koniec egzonu 53 koduje kodon AAG dla lizyny w pozycji 2624 (K-2624) w sekwencji aminokwasowej dystrofiny i ten egzon 53 jest połączony z tępym końcem eksonu 54, który sam koduje pełny kodon dla następującej reszty kwasu glutaminowego (Q-2625). Jednak inne egzony kodują niekompletne kodony aminokwasowe na swoich końcach: koniec egzonu 52 koduje pierwszy nukleotyd „C” izoleucyny (I-2554 czerwoną czcionką) i wymaga następnych 2 zasad tymidynowych egzonu 53, aby uzupełnić kodon (C-TT w DNA lub CUU w RNA) ( ryc. 1). Mutacje delecyjne, w których pozostałe egzony mają tę samą ramkę odczytu, są „w ramce odczytu”, a po połączeniu prowadzą do stosunkowo stabilnego mRNA kodującego częściowo funkcjonalną dystrofinę pozbawioną aminokwasów odpowiadających usuniętym egzonom. Z drugiej strony, pozostałe egzony, które nie mają tej samej ramki odczytu, są „poza ramką”, a gdy pozostałe egzony są połączone w mRNA, rybosom napotyka translacyjne przesunięcie ramki, co prowadzi do zatrzymania w translacji białka dystrofiny. Większość transkryptów mRNA z przedwczesnymi kodonami stop uruchamia mechanizm rozpadu za pośrednictwem nonsensu (NMD), który kieruje te mRNA poza ramką do degradacji. W przypadku genu DMD wydaje się, że przedwczesne kodony stop mogą również prowadzić do zmian epigenomicznych w genie, zmniejszając również ekspresję mRNA [ 31Terapie Egzon-skipping celują w zmutowane kodony za pomocą zaprojektowanych związków chemicznych tzw. oligonukleotydów antysensownych (AON), aby możliwe było stworzenie skróconego białka dystrofiny, które zachowuje częściową funkcjonalność oryginalnej dystrofiny ( Echevarría i wsp., 2018 ). AON stosuje się do kontrolowania splicingu pre-mRNA przez usunięcie jednego proksymalnego (sąsiedniego) exonu leżącego bezpośredni przed lub za miejscem wystąpienia delecji ( Kinali i wsp., 2009 ) tak aby wznowić ramkę odczytu.
W 2016 roku amerykańska Agencja ds. Żywności i Leków (FDA) zatwierdziła:
Eteplirsen (Exondys 51), który może specyficznie pomijać ekson 51 w wadliwych wariantach genów dla DMD ( Lim i wsp., 2017 ). Eteplirsen wykazuje obiecujące wyniki w 6-minutowym teście marszu (6MWT), który mierzy odległość, jaką pacjent może samodzielnie przejść w ciągu 6 minut ( Cirak et al., 2011).
W 2019 i 2020 roku Golodirsen i Viltolarsen zostały odpowiednio zatwierdzone przez FDA ( Heo, 2020 ; Al Musaimi i in., 2021 ). Oba leki są przeznaczone dla pacjentów z mutacją podatną na pominięcie eksonu 53 ( Dzierlega i Yokota, 2020 ). Czterdzieści do osiemdziesięciu tygodni leczenie Golodirsenem znacząco zwiększa ekspresję białka dystrofiny w mięśniach pacjentów z DMD ( Frank et al., 2020 ). Podobny korzystny wynik w poziomie dystrofiny obserwuje się również u pacjentów, którzy otrzymali leczenie Viltolarsenem ( Iftikhar i wsp., 2020 ).
Podejścia do edycji DNA CRISPR, które nie zostały jeszcze przeprowadzone w badaniach klinicznych dotyczących DMD, mają na celu zmodyfikowanie genomowego DNA miofiber w celu przekształcenia DMD poza ramką w delecję podobną do BMD w ramce. CRISPR polega na dostarczeniu maszynerii do edycji DNA za pomocą wektorów wirusowych. Drugim podejściem do osiągnięcia pominięcia eksonu jest blokowanie splicingu za pośrednictwem U7 snRNP, podobne w mechanizmie działania do podejść oligonukleotydowych. Wektory AAV zastosowano do dostarczania zmodyfikowanych genów U7 snRNP, w których normalna część antysensowna, która hybrydyzuje z RNA histonu jest zastąpiona sekwencją antysensowną ukierunkowaną (w tym przypadku) na ekson dystrofiny. Nie dotyczy to mRNA, ale pre-mRNA (jak przeskakiwanie egzonów za pomocą oligonukleotydów).30 ].
2. Zatrzymaj przeczytanie kodonu
Niektóre nonsensowne mutacje mogą skutkować przedwczesnymi kodonami stop (PSC) i powodować dysfunkcyjną dystrofinę ( Ng i wsp., 2021 ). Około 13% pacjentów z DMD jest spowodowanych tymi nonsensownymi mutacjami ( Aartsma-Rus i in., 2016 ). W przeciwieństwie do mutacji przesunięcia ramki, PSC nie zakłócają ramki odczytu, ale przedwcześnie kończą translację podczas syntezy białek. Niektóre małe cząsteczki zostały zaprojektowane tak, aby łączyć się z tymi PSC i stymulować odczyt kodonu stop ( Malik et al., 2010 ; Aartsma-Rus et al., 2016 ). Jednym z przedstawicieli jest Gentamycyna ( Baradaran-Heravi et al., 2017 ). Jednak ciągłe stosowanie gentamycyny jest zabronione ze względu na działania niepożądane, w tym toksyczność nerkową i ototoksyczność (Vitiello i in., 2019 ). Dwie pochodne gentamycyny, NB74 i NB84, wykazują zmniejszoną toksyczność komórkową i lepszą wydajność odczytu in vitro ( Nudelman i wsp., 2010 ). Inny antybiotyk aminoglikozydowy Ataluren (NPC-14) wykazał skuteczne działanie odczytu w badaniach przedklinicznych ( Guiraud i Davies, 2017 ) i może potencjalnie zapewnić leczenie około 11% wszystkich pacjentów z DMD z mutacją nonsensowną ( Namgoong i Bertoni, 2016 ) . W 2016 roku Ataluren został zatwierdzony przez Europejską Agencję Leków (EMA) do leczenia DMD ( Finkel i wsp., 2013 ; McDonald i wsp., 2017). Jednak badanie kliniczne fazy 3 wykazało, że pacjenci w wieku 7-16 lat po otrzymywaniu Atalurenu przez 48 tygodni nie wykazywali znaczących zmian w 6MWD w porównaniu z pacjentami otrzymującymi placebo ( McDonald i wsp., 2017 ). Na tej podstawie lek nie uzyskał aprobaty FDA ( McDonald i in., 2017 ).
3. Dodawanie genów
Ponieważ DMD jest spowodowane mutacjami w genie DMD . Bardzo atrakcyjną terapią genową jest zastąpienie dysfunkcyjnego genu DMD prawidłowym genem ( Ricci i wsp., 2019 ). Wirus związany z adenowirusem (AAV) jest wektorem wirusowym, który może infekować mięśnie szkieletowe z wysoką wydajnością ( Zhang i wsp., 2020 ), który można wykorzystać jako wektor dostarczający. Jednak pojemność transgenu AAV jest ograniczona, a pełnej długości transkrypty mRNA dystrofiny genu DMD są wyjątkowo duże w przypadku AAV ( Duan, 2018 ). Aby rozwiązać tę przeszkodę, cały gen dystrofiny skraca się do częściowo funkcjonalnego genu mikrodystrofiny i pakuje do AAV ( Banks i wsp., 2010 ;Ramos i in., 2019 ). Liczne serotypy AAV zostały zbadane na modelach zwierzęcych ( Wasala i wsp., 2019 ). Spośród kilku serotypów AAV, serotypy 1, 6, 8 i 9 są znakomitymi kandydatami do terapii DMD, ponieważ wykazują silny tropizm do mięśni prążkowanych ( Inagaki i wsp., 2006 ; Leborgne i wsp., 2019 ). Ostatnio trwa kilka badań klinicznych opartych na mikrodystrofinach AAV (NCT03362502, NCT03375164 i NCT03368742; Tabela 1 ). Dane od 19 pacjentów, którzy otrzymali roczne leczenie w badaniu fazy 1b (NCT03362502) wykazały, że leczenie PF-06939926 może indukować ciągłą produkcję częściowego funkcjonalnego białka dystrofiny w tkankach mięśniowych i poprawę funkcji motorycznych (Belluscio i in., 2021 ). PF-06939926 otrzymał oznaczenie leku sierocego zarówno przez FDA, jak i EMA i wszedł do badania fazy 3 (NCT04281485). Zaprojektowano inny transgen mikro-dystrofiny (rAAVrh74.MHCK7.micro-dystrofina), który ma wyższą skuteczność dostarczania niż PF-06939926 ( Potter et al., 2021 ). U myszy mdx, po 3-miesięcznym leczeniu rAAVrh74.MHCK7.micro-dystrofiną, zaobserwowano wzmocnienie siły właściwej przepony i mięśnia piszczelowego przedniego ( Potter i wsp., 2021 ).
4. Edytowanie genów
Do korygowania mutacji w genie DMD wykorzystano edytowanie genów CRISPR (zgrupowane regularnie rozmieszczone krótkie powtórzenia palindromiczne) Cas 9 (białko związane z CRISPR) jako potężne narzędzie do modelowania, a nawet korygowania nieprawidłowości genetycznych ( Wang i wsp., 2017 ; Lek i al., 2020 ). CRISPR/Cas9 to adaptacyjny układ odpornościowy bakterii przeciwko atakującym bakteriofagi, a później opracowany jako narzędzie do edycji DNA ( Jinek i wsp., 2012 ). Specyficzne pęknięcia dwuniciowego DNA mogą być indukowane przez technologię CRISPR/Cas9 w genomie i dalej aktywować systemy naprawy DNA ( Karimian i wsp., 2019). A systemy naprawy DNA skorygują mutacje zmiany sensu poprzez edycję linii zarodkowej opartą na homologii opartą na naprawie lub edycję postnatalną opartą na niehomologicznym łączeniu końców (NHEJ) ( Long i in., 2014 , 2016 ; Bengtsson i in., 2017 ; Zhang i in. al., 2017 ). AAV były szeroko wykorzystywane do dostarczania CRISPR/Cas9 in vivo ( Samulski i Muzyczka, 2014 ). U myszy mdx korekta delecji eksonu 23 przez terapię AAV8-CRISPR/Cas9 może przywrócić ekspresję funkcjonalnego białka dystrofiny w mięśniowłóknach szkieletowych i znacząco zwiększyć siłę mięśni ( Nelson i wsp., 2016). Poza tym inne badanie wykazało, że AAV6-CRISPR/Cas9 może korygować delecje zarówno eksonu 52, jak i 53 oraz znacząco zwiększać generowanie siły u myszy mdx ( Bengtsson i wsp., 2017 ). Edycja genów CRISPR/Cas9 dostarczana przez wektory AAV może potencjalnie przynieść korzyści kliniczne około 60% pacjentów z DMD ( Echigoya i wsp., 2015 ; Ousterout i wsp., 2015a , b ; Taglia i wsp., 2015 ). Jednak wydajność edycji genomu za pośrednictwem CRISPR/Cas9 jest silnie zależna od dawki AAV ( Min i wsp., 2019b ). Nieuchronnie nadmierna odpowiedź immunologiczna wywołana przez egzogenne AAV i Cas9 może stanowić wyzwanie dla ich skutecznego zastosowania klinicznego ( Zhang i wsp., 2020). Wciąż potrzebne są dalsze badania, aby zrozumieć mechanizm i częstotliwość efektów pozacelowych ( Echigoya i in., 2015 ; Feng i in., 2015 ; Hollinger i Chamberlain, 2015 ). Powiązane badania trwają w celu wygenerowania bardziej specyficznych enzymów Cas9 ( Zheng i wsp., 2018 ).
(https://link.springer.com/referenceworkentry/10.1007/978-1-4020-6754-9_5694)
Z mutacją punktową mamy do czynienia w przypadku zmian występujących w pojedynczym nukleotydzie. Mogą to być zmiany związane z delecją pojedynczego nukleotydu, dodaniem, zastąpieniem czy duplikacją.
Co to jest ten nukleotyd ?
Ponieważ strona ta przeznaczona jest głównie dla osób chorujących lub ich opiekunów pozwolę sobie na zrobienie pewnego porównania:
Ciąg dalszy nastąpi 🙂
Cicha
Mutacja tego rodzaju dotyczy zazwyczaj trzeciej zasady w kodonie i nie powoduje zmian w produkcji białka. Jest to spowodowane tym, że kilka kodonów odpowiada za wytworzenie tego samego aminokwasu.
Mutacja taka nie powoduje chorób jest dla naszego organizmu obojętna. Powstające białko jest takie samo jak przed mutacją.
Zmiana sensu
Mutacja tego rodzaju dotyczy zmiany zasady w kodonie w taki sposób, że w wyniku procesu translacji (produkcji białka) powstaje inny aminokwas (w naszym przypadku zamiast GLICYNY powstaje ARGININA), a całe białko składające się z łańcucha różnych aminokwasów różni się od białka przed mutacją tylko tym jednym aminokwasem.
Zazwyczaj tego typu mutacja nie wiąże się z dotkliwymi chorobami ale czasem taka niewielka zmiana może prowadzić do poważnej choroby. Przykładem jest zmian zasady “A”->”G” w kodonie “GAG” ->”GTG” w genie odpowiedzialnym za tworzenie białka hemoglobiny. Zmiana ta powoduje chorobę zwaną anemią sierpowatą charakteryzującą się tym, żę cząsteczki hemoglobiny sierpowatej sklejają się ze sobą, tworząc sztywne pręciki, które powodują, że czerwone krwinki przybierają zniekształcony, przypominający sierp kształt, nadając tej chorobie nazwę. Sztywne, zniekształcone komórki krwi nie przenoszą dobrze tlenu, a także mają tendencję do zatykania naczyń włosowatych, powodując odcięcie dopływu krwi do różnych tkanek, w tym mózgu i serca. Dlatego też, gdy dotknięta chorobą osoba doświadcza nawet niewielkiego wysiłku, prowadzić to może do strasznego bólu, chory może doznać zawału serca lub udaru mózgu — wszystko z powodu pojedynczej zmiany zasady.
Żródło: https://www.nature.com/scitable/topicpage/genetic-mutation-441/
Nonsensowna
W prawidłowym mRNA (stworzonym przez połączenie Eksonów) do każdego kolejnego kodonu (z wyjątkiem kodonu STOP) podjeżdża wagonik zwany tRNA wiozący aminokwas. Aminokwasy łączą się kolejno ze sobą tworząc łańcuch czyli biało np. Dystrofinę. Kodon STOP zatrzymuje ten proces i białko nie powstaje.
Naprawa tego uszkodzenia polega na znalezieniu takiego wagonika tRNA, który będzie wstanie rozpoznać, że to jest zmiana oraz podłączyć się do tego zmienionego kodonu (STOP) dostarczając inny od oryginalnego aminokwas. Dzięki takiej operacji nie następuje przerwanie produkcji białka, a powstałe białko różni się od oryginalnego tylko tym jednym aminokwasem.
Lekiem, który działa w ten sposób jest Ataluren firmy Translarna.

Mutacje przesunięcia ramki odczytu (frameshift)
Wstęp
Przepraszamy, zagadnienie w trakcie uzupełniania
Aaa
Przepraszamy, zagadnienie w trakcie uzupełniania
Bb
Przepraszamy, zagadnienie w trakcie uzupełniania